Structure biomoléculaire et analyse de carbohydratesBiomolecular structure and carbohydrate analysis
A. Infantino, O. Yeni, and I. Compagnon
Il existe dans la nature trois familles de biopolymères qui sont à la base de la composition et du fonctionnement du vivant : les polynucléotides (ADN), les protéines et les glycanes (ou carbohydrates). Depuis des décennies, les technologies de séquençage permettent de déchiffrer aussi bien la structure de l’ADN que celle des protéines. Ces méthodes de séquençage n’existent pas pour les glycanes à cause de la complexité unique de leur structure moléculaire. La difficulté d’analyse porte à la fois sur l’identification des monomères constituants (des isomères dont les structures sont difficiles à différencier avec les approches analytiques actuelles) et sur la caractérisation des liaisons glycosidiques, dont la position et la stéréochimie peuvent modifier les propriétés physico-chimiques et biologiques du glycane. Pourtant les glycanes ont une importance capitale en santé, nutrition, matériaux ou énergies renouvelables.
In nature, three families of biopolymers are at play in biological mechanisms: polynucleotides (DNA), proteins and glycans (or carbohydrates). Decades ago, sequencing technologies have been developed to decipher the sequence of DNA and proteins. Such sequencing technologies do not exist yet for glycans because of the complexity of their molecular structure. The major difficulty lies in the identification of the constituent monomers (isomers whose structures are difficult to differentiate with current analytical approaches), and the characterization of glycosidic bonds, whose position and stereochemistry modulates the physico-chemical and biological properties of glycan. However, glycans are of paramount importance in health, nutrition, materials or renewable energy.
Pour lever ce verrou, nous avons combiné des techniques avancées de spectrométrie de masse et de spectroscopie moléculaire : la spectroscopie IRMPD (InfraRed Multiple Photon Dissociation). Le couplage IRMPD développé à Lyon permet d’obtenir l’empreinte vibrationnelle d’ions sélectionnés en masse dans la gamme des vibrations OH, NH et CH. Ces empreintes vont permettre de caractériser le détail de la structure moléculaire de glycanes.
In order to advance carbohydrate sequencing, we have combined mass spectrometry and molecular spectroscopy techniques (IRMPD spectroscopy: InfraRed Multi-Photon Dissociation). The IRMPD coupling developed in Lyon makes enables the measurement of the vibrational fingerprint of mass selected ions in the spectral range of OH, NH and CH vibrations. These fingerprints provide a unique diagnostic of glycan structures.
Nos activités de recherche
Research activities
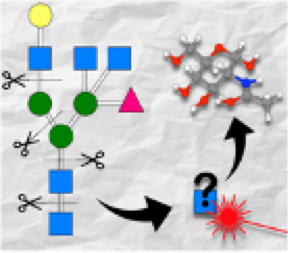
Structure de carbohydrates: concepts fondamentaux
Carbohydrate structure: fundamental concepts
Nous avons établi que l’empreinte vibrationelle permet de distinguer des variations de structure infimes et d’identifier tous les types d’isomérie présent dans les glycanes. De plus, nous avons démontré que lors d’une analyse de type MS/MS combinée à l’IRMPD, certains fragments conservent la mémoire de la structure initiale. Ces concepts sont à l’origine de la méthode de séquençage développée dans l’équipe.
We have established that the vibrational fingerprint allows distinguishing minute variations in closely related structures, and identifying all types of isomerism present in glycans. In addition, we have shown that MS/MS fragments maintain the memory of the initial structure. Such concepts are at the origin of the sequencing method developed by the team.
B. Schindler et al. PCCP 16, 22131 (2014)L. Barnes et al. PCCP 17, 25705 (2015) C. J. Gray et al. Anal. Chem. 89, 4540 (2017) L. Barnes et al. IJMS 421, 116 (2017) B. Schindler et al. Nature Commun. 8, 973 (2017) A. Depraz-Depland et al. IJMS 434, 65 (2018)L. Barnes et al. IJMS 447, 116235 (2020) C. J. Gray et al. JACS 141, 14463(2019)

Développements instrumentaux
Instrumental developments
Afin de déployer notre approche spectroscopique pour le séquençage de glycane dans la communauté de glycoscience, nos développements instrumentaux portent sur une intégration fluide et transparente de la spectroscopie InfraRouge d’ions dans des workflows analytiques. Ces développements permettent d’augmenter l’information structurelle obtenue par les protocoles analytiques couramment utilisés en glycomique, en y ajoutant une information spectroscopique supplémentaire “post-barrière isomérique”
In order to deploy our spectroscopic approach for glycan sequencing in the glycoscience community, our instrumental developments aim to a fluid and transparent integration of InfraRed ion spectroscopy in analytical workflows. Such integration increases the structural information obtained by the analytical protocols commonly used in glycomics, by adding an additional “post-isomeric barrier” spectroscopic information.
B. Schindler et al. IJIMS 20 119 (2017)
J. Wattjes et al. Pure and Applied Chemistry 89 1349 (2017)
B. Schindler et al. Anal. Chem. 90 11741 (2018)
L. Jaravel et al. Journal of Chromatography A In press (2019)
Application à des systèmes biologiques: le projet ALGAIMS
Application to biological systems: the ALGAIMS project
Le projet ANR ALGAIMS rassemble un consortium interdisciplinaire (ILM, INRA Nantes, Univ. Rennes et ENSC Rennes) qui s’intéresse à la corrélation entre les propriétés de résistance des lichen à des conditions extrêmes, et la présence d’une forme rare du galactose, la galactofuranose, au sein de la structure de ses polysaccharides.
The ANR ALGAIMS project brings together an interdisciplinary consortium (ILM, INRA Nantes, Univ. Rennes and ENSC Rennes) which is interested in the correlation between the resistance properties of lichens under extreme conditions, and the presence of a rare form of galactose, galactofuranose, within the structure of its polysaccharides.
ANR (2018)
B. Schindler et al. PCCP 21 12460 (2019)
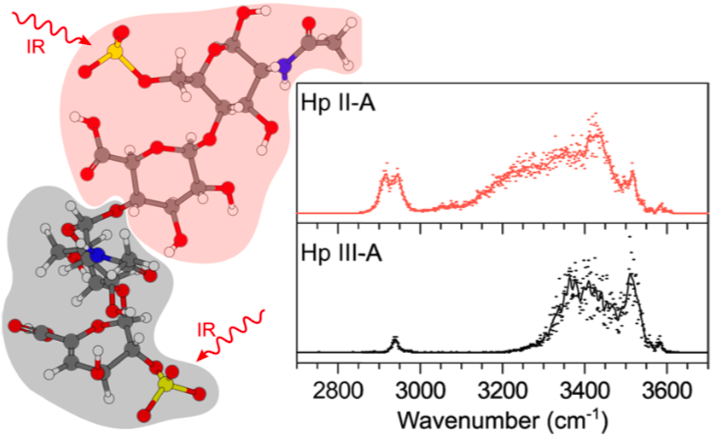
Application à des systèmes biologiques: les glycosaminoglycanes
Application to biological systems: the glycosaminoglycanes
Les glycosaminoglycanes sont des polysaccharides linéaires présents à la surface des cellules et dans la matrice extra cellulaire. Ils interviennent dans de nombreux effets physiologiques et pathologiques comme le développement embryonnaire, la différenciation, la réponse inflammatoire ou le développement tumorale. Ces polysaccharides sont sulfatés et la caractérisation fine de ces motifs de sulfatation est au cœur de la compréhension de l'interaction entre la cellule et son environnement.
Glycosaminoglycans are linear polysaccharides located on the surface of cells and in the extra cellular matrix. They are involved in many physiological and pathological effects such as embryonic development, differentiation, inflammatory response or tumor development. These polysaccharides are sulfated and the fine characterization of these sulfation patterns is at the heart of understanding the interaction between the cell and its environment
B. Schindler et al. Glycoconjugate Journal 34 421 (2017)
B. Schindler et al. J. Phys. Chem. A 121 2114 (2017)
I. Compagnon et al. Current Opinion in Structural Biology 50 171 (2018)
G. Renois-Predelus et al. J. Am. Soc. Mass Spectrom. 29 1242 (2018)
Nos activités de Valorisation
Outreach activities
Développement de la technologie de séquençage
In partnership with our local technology transfert offices
En partenariat avec les acteurs de valorisation (
SATT Pulsalys,
SPV CNRS,
EZUS-Lyon), nous sommes engagés dans un programme de maturation de la technologie de séquençage, visant à un transfert industriel. Ce programme a été soutenu par un financement de préparation CNRS et un financement de maturation SATT.
In partnership with technology transfert institutions (
SATT Pulsalys,
SPV CNRS,
EZUS-Lyon), we are involved in a maturation program on the sequencing technology, aiming at an industrial transfer. This program was supported by CNRS funding and SATT maturation funding.
Accueil de projets de recherche industrielle
Industrial research and R&D projects
En parallèle au développements technologiques, nous accueillons dans le cadre de la plateforme IROGLYPH des projets de recherche industriels avec des acteurs de la santé, pharmacie et nutrition.
In parallel with technological developments, we are hosting, through the IROGLYPH platform, industrial research projects in health, pharmacy and nutrition.
IROGLYPH plateform
Financements, distinctions et partenariat
Fundings, Awards and partnership