Quantifier le transport de nanothérapies en 3D
Quantifying the transport of nanotherapies in 3D
Saba Goodarzi, Audrey Prunet, Hélène Delanoë-Ayari et Charlotte Rivière (équipe Biophysique), en collaboration avec Fabien Rossetti, Guillaume Bort, Olivier Tillement et François Lux (équipe FENNEC), et avec des collègues d’Orsay ont publié un article intitulé "Quantifying nanotherapeutics penetration using hydrogel based microsystem as a new 3D in vitro platform" dans la revue Lab-On-Chip.
Saba Goodarzi, Audrey Prunet, Hélène Delanoë-Ayari and Charlotte Rivière (Biophysic team), in collaboration with Fabien Rossetti, Guillaume Bort, Olivier Tillement and François Lux (FENNEC team), and with colleagues from Orsay published an article entitled "Quantifying nanotherapeutics penetration using hydrogel based microsystem as a new 3D in vitro platform" in the journal Lab-On-Chip.
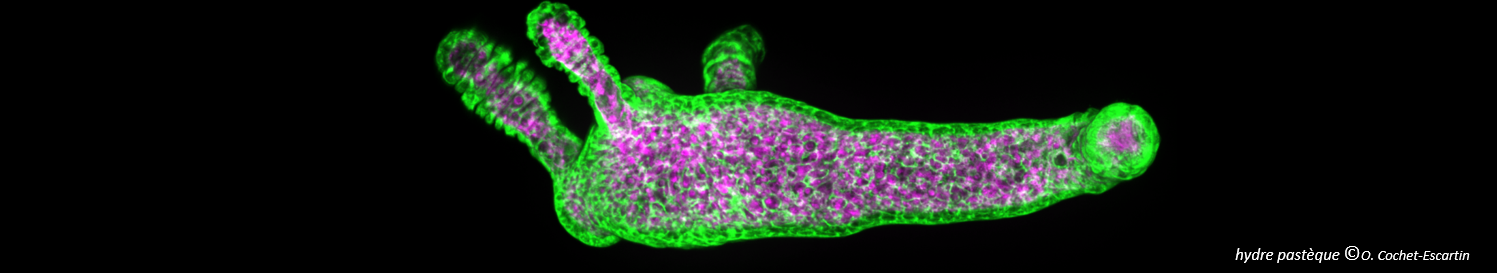
Il y a aujourd’hui un écart considérable entre les essais in vitro en 2D utilisés pour le criblage des médicaments et l'environnement physiologique in vivo. Cet écart empêche de prédire correctement le parcours et l'accumulation des nanothérapies in vivo. Dans ce contexte, les sphéroïdes tumoraux multicellulaires apparaissent comme un modèle in vitro alternatif intéressant pour prendre en compte l’architecture 3D rencontrée in vivo. Cependant, les approches classiques pour produire ces « mini-tumeurs » sont difficiles à utiliser à grande échelle car elles demandent beaucoup de manipulations. Il est également difficile d’imager ce qui se passe à l’intérieur de ces sphéroïdes de manière simple.
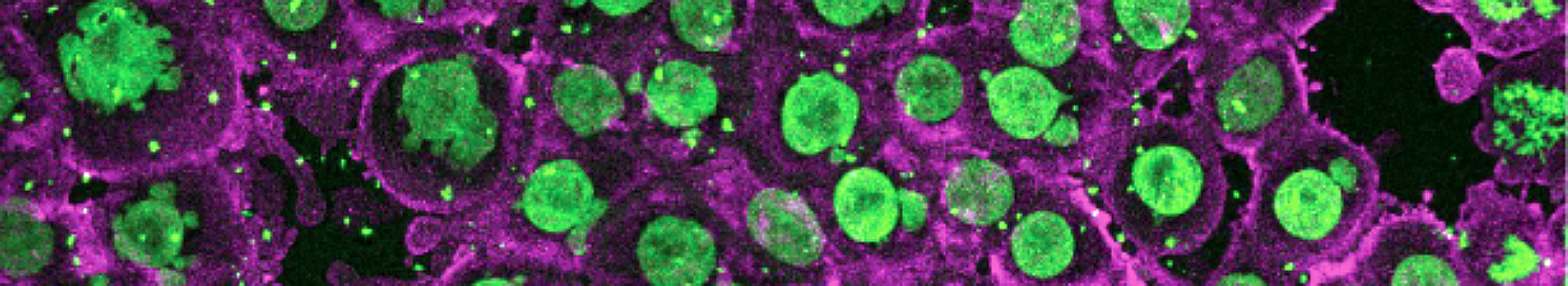
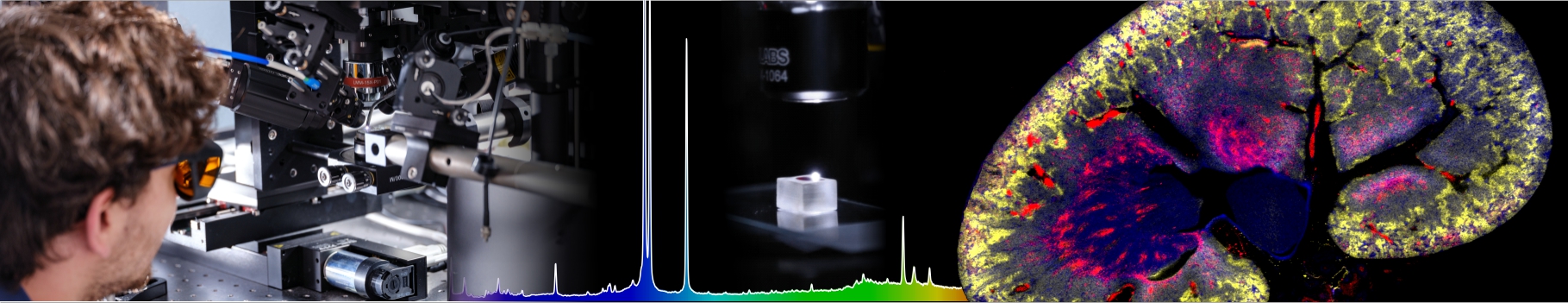
Les auteurs ont développé un microsystème en hydrogel simple mais très flexible permettant de produire et imager facilement des centaines de sphéroïdes en parallèle. Comme preuve de principe de la pertinence d'une telle plateforme, les auteurs ont quantifier la pénétration et la distribution des nanoparticules AGuIX® (rendues fluorescentes) dans les sphéroïdes au cours du temps. Ils ont notamment mis en évidence une localisation intracellulaire différente en 2D et en 3D. Ceci démontre l’importance d’une telle approche pour étudier le transport des nanothérapies, en amont des études in vivo.
Les auteurs ont développé un microsystème en hydrogel simple mais très flexible permettant de produire et imager facilement des centaines de sphéroïdes en parallèle. Comme preuve de principe de la pertinence d'une telle plateforme, les auteurs ont quantifier la pénétration et la distribution des nanoparticules AGuIX® (rendues fluorescentes) dans les sphéroïdes au cours du temps. Ils ont notamment mis en évidence une localisation intracellulaire différente en 2D et en 3D. Ceci démontre l’importance d’une telle approche pour étudier le transport des nanothérapies, en amont des études in vivo.
Today, there is a huge gap between the 2D in vitro assays used for drug screening and the in vivo physiological environment. This gap prevents the correct prediction of the pathway and accumulation of nanotherapies in vivo. In this context, multicellular tumor spheroids appear as an interesting alternative in vitro model to take into account the 3D architecture encountered in vivo. However, classical approaches to produce these "mini-tumors" are difficult to use on a large scale because they require a lot of manipulation. It is also difficult to image inside these spheroids in a simple way.
The authors have developed a simple but very flexible hydrogel microsystem that can easily produce and image hundreds of spheroids in parallel. As a proof of principle of the relevance of such a platform, the authors quantified the penetration and distribution of AGuIX® nanoparticles (made fluorescent) in spheroids over time. In particular, they highlighted a different intracellular localization in 2D and 3D. This demonstrates the importance of such an approach to study the transport of nanotherapies, before in vivo studies.
The authors have developed a simple but very flexible hydrogel microsystem that can easily produce and image hundreds of spheroids in parallel. As a proof of principle of the relevance of such a platform, the authors quantified the penetration and distribution of AGuIX® nanoparticles (made fluorescent) in spheroids over time. In particular, they highlighted a different intracellular localization in 2D and 3D. This demonstrates the importance of such an approach to study the transport of nanotherapies, before in vivo studies.