Comment ça marche ?
Un luminophore est un matériau qui absorbe de l’énergie sous forme de photons plus ou moins énergétiques et qui transforme cette énergie en lumière visible. Pour simplifier notre explication nous ne considérerons ici que les matériaux inorganiques à large "gap", c’est à dire des matériaux isolants qui n’absorbent pas la lumière visible et qui par conséquent nous apparaissent comme étant blancs. Il existent également des matériaux semi-conducteurs qui sont luminescents mais nous n’en parlerons pas ici, le principe de fonctionnement étant le même dans tous les cas. Les luminophores sont donc des matériaux qui se présentent sous la forme de poudres blanches (d’où l’aspect des tubes fluorescents). On introduit volontairement dans ces matériaux, lors de leur synthèse, des impuretés qui vont leur conférer leur propriété luminescente. Ces impuretés sont soit des ions de transitions (comme le manganèse, le chrome,...) ou plus souvent des ions terres rares (comme l’europium, le terbium,...). La théorie des bandes montre que les électrons des atomes constituant un matériau, du fait de la périodicité du réseau cristallin, n’occupent que certaines bandes d’énergie. La plus énergétique des bandes "pleine" s’appelle la bande de valence, alors que la moins énergétique des bandes vides porte le nom de bande de conduction. Les ions impuretés, introduits en très faible quantité (quelques %), brisent la périodicité du réseau cristallin et leurs électrons se placent sur des niveaux d’énergie qui leur sont propres et qui se situent dans la bande interdite du matériau hôte, entre la bande de valence et la bande de conduction. Ces électrons sont la plupart du temps dans le niveau le moins énergétique que l’on désigne sous le nom de niveau fondamental, mais ils peuvent également se placer sur des niveaux plus énergétiques dits "excités " tout en restant intimement liés à leur atome d’origine. C’est en absorbant l’énergie lumineuse que les électrons peuvent atteindre ces niveaux excités, et c’est en "retombant" sur l’état fondamental qu’ils cèdent l’énergie acquise précédemment sous la forme d’un photon. Pour comprendre comment l’énergie absorbée peut être différente de celle émise, il faut faire appel à un modèle, très simplifié mais très largement utilisé par les spectroscopistes, qui est le modèle des courbes de configuration. Dans ce modèle on représente les niveaux d’énergie par des paraboles qui représentent le couplage des ions impuretés avec les vibrations du réseau cristallin. En effet dans un cristal, à température ambiante, tous les atomes vibrent suivant des modes de vibration qui dépendent de la structure du cristal. Ces modes de vibration sont assez complexes mais on a l’habitude de simplifier les choses et de considérer uniquement le mode le plus symétrique (que l’on appelle le mode "respiratoire") 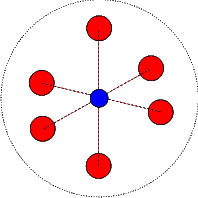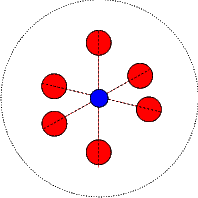 dans lequel les atomes proches voisins d’un ion impureté s’éloignent ou se rapprochent de lui en même temps et de la même distance, comme si l’ion impureté était au centre d’une sphère sur la surface de laquelle seraient disposés les atomes voisins et que celle-ci se gonfle et se dégonfle périodiquement. Par une telle simplification on peut se placer dans le cadre de de l’approximation de l’oscillateur harmonique, d’où les paraboles citées plus haut, dont le minimum correspond à des états d’équilibre.
dans lequel les atomes proches voisins d’un ion impureté s’éloignent ou se rapprochent de lui en même temps et de la même distance, comme si l’ion impureté était au centre d’une sphère sur la surface de laquelle seraient disposés les atomes voisins et que celle-ci se gonfle et se dégonfle périodiquement. Par une telle simplification on peut se placer dans le cadre de de l’approximation de l’oscillateur harmonique, d’où les paraboles citées plus haut, dont le minimum correspond à des états d’équilibre.
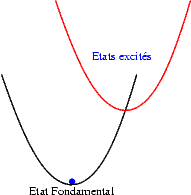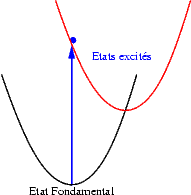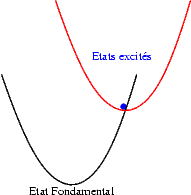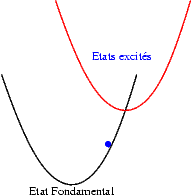
Lorsqu’un photon de grande énergie est absorbé par l’ion, un électron passe de l’état fondamental vers un des états excités qui se situe à une énergie qui correspond à celle du photon. Ce changement d’état électronique peut s’accompagner d’une modification de la position d’équilibre des atomes : on dit que le système "relaxe". Une fois dans son état excité notre électron n’aspire qu’à une seul chose : retourner dans sont état fondamental ! Plusieurs cas peuvent alors se produire :
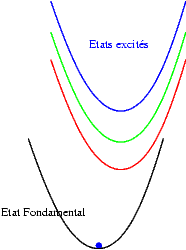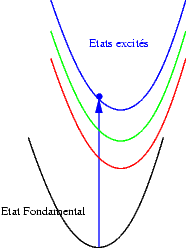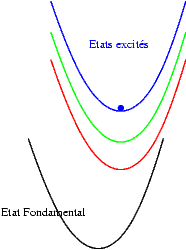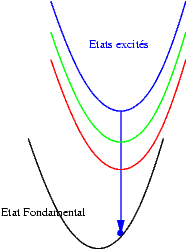
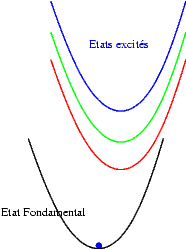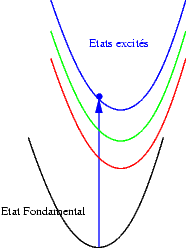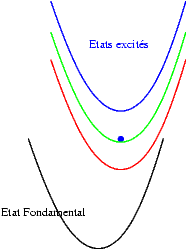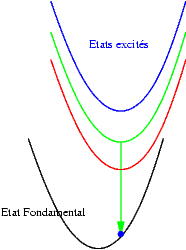
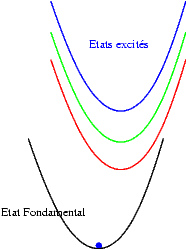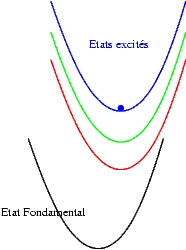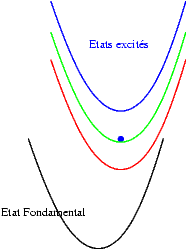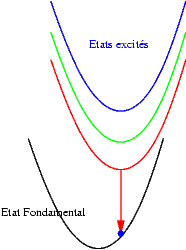
| Si les niveaux excités sont très proches les uns des autres, les probabilités de transitions non radiatives (sans émission de photons) sont très grandes et l’électron redescend très rapidement vers le niveau excités le plus bas et rejoint finalement son état fondamental en émettant un photon dont l’énergie est bien plus faible que celle du photon initialement absorbé. Le schéma illustre ce mécanisme. On y voit successivement : l’absorption d’un photon "bleu", la relaxation de l’électron, et enfin l’émission d’un photon "rouge". | 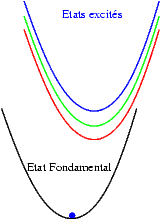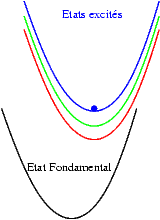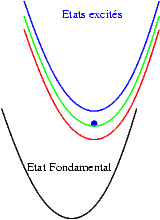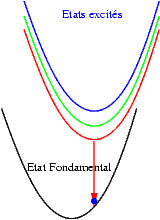 |
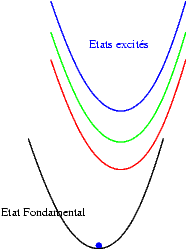
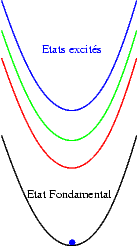
Si les niveaux excités sont plus espacés les uns des autres, les probabilités de transitions non radiatives sont plus faibles et on peut alors observer les émissions des différents états excités. Les transitions issues du niveau excité le plus bas restent cependant souvent les plus intenses. Sur les schémas suivants on observe les mécanismes donnant une émission "bleue", "verte" ou "rouge".
 |
 |
 |
Le décalage entre la courbe de l’état fondamental et celles des états excités dépend de la nature des ions : les ions de transitions sont caractérisés par un décalage important qui est à l’origine de la nature large bande de leurs émissions dues à des transitions interconfigurationnelles . A l’inverse dans les ions terres rares trivalents ce décalage est nul car les niveaux excités et le niveau fondamental sont issus de la même configuration électronique (4fn) qui est "protégée" de l’influence du champs cristallin par les orbitale externes 5s2 et 5p6. On obtient dans ce cas des émissions de raies étroites, ce sont des transitions intraconfigurationnelles .
 |
 |
|
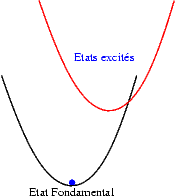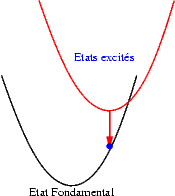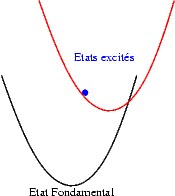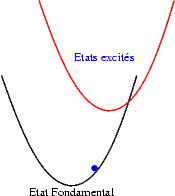
Si le décalage entre les états excités et l’état fondamental devient important, alors, sous l’effet de l’énergie thermique les électrons de l’état excité ont une probabilité non nulle de franchir la barrière de potentiel qui les séparent de l’état fondamental et de relaxer dans cet état. L’intensité émise diminue lorsque la température augmente. C’est le phénomène d’extinction thermique. |
Si le décalage augmente encore, l’extinction de la luminescence est permanente, , quelque soit la température : |
 |
 |