Un dispositif parallélisant l’électroporation de mini-tumeurs
A platform for parallel electroporation of mini-tumors
Pauline Bregigeon et Charlotte Rivière (équipe Biophysique), en collaboration avec des collègues d’Ecully et de Villeurbanne ont publié un article intitulé " Integrated platform for culture, observation, and parallelized electroporation of spheroids" dans la revue Lab-On-Chip. Cet article a fait l’intérieur de la couverture de la revue.
Pauline Bregigeon and Charlotte Rivière (Biophysic team), in collaboration with colleagues from Ecully and Villeurbanne have published an article entitled " Integrated platform for culture, observation, and parallelized electroporation of spheroids " in the journal Lab-On-Chip. This article was chosen as the journal’s back-cover.
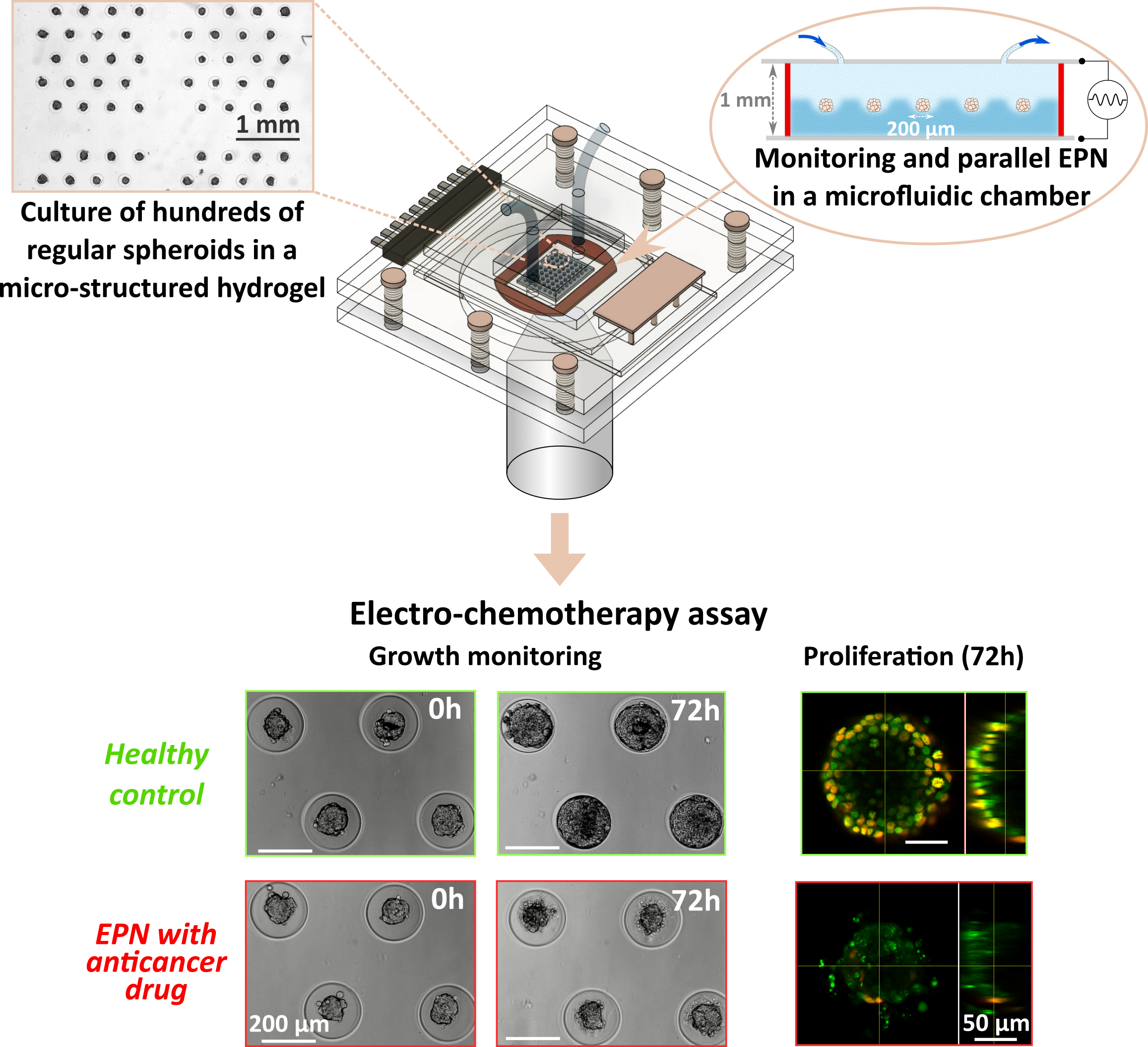
L'intérêt clinique pour les thérapies basées sur l'électroporation (EPN) a considérablement augmenté ces dernières années, en tant que traitement alternatif des tumeurs, en réduisant les effets secondaires et les coûts. Afin d'améliorer et d'optimiser ce type de traitements, des modèles cellulaires in-vitro 3D sont nécessaires pour mieux reproduire le contexte in-vivo et réduire les études sur les animaux. Les protocoles d'EPN in-vitro couramment utilisés ne sont pas adaptés à de tels modèles 3D. Les auteurs comblent cette lacune en développant un dispositif unique permettant la culture, le suivi et l'électroporation avec le même champ électrique de centaines d'agrégats cellulaires en parallèle.
Un tel microsystème pourrait être d'une importance capitale pour de futures études visant à mieux comprendre l'effet de l'EPN dans un contexte 3D, à optimiser son efficacité et la sélection des médicaments associés, avant les études in-vivo.
Un tel microsystème pourrait être d'une importance capitale pour de futures études visant à mieux comprendre l'effet de l'EPN dans un contexte 3D, à optimiser son efficacité et la sélection des médicaments associés, avant les études in-vivo.
The clinical interest in electroporation-based (EPN) therapies has drastically increased in the last few years, as an alternative tumor treatment with reduced side effects and costs. To improve and optimize such treatments, relevant 3D in-vitro cell models are needed, to better reproduce in-vivo context and reduce animal studies. Commonly used in vitro EPN protocols are not adapted to such 3D models. The authors are filling that gap by developping a unique device enabling culture, monitoring, and electroporation of hundreds of regular 3D cell assemblies in parallel, with the same electric field.
Such a microsystem could be of primary importance for future studies to better understand the EPN effect in a 3D context and to optimize EPN efficiency and associated drug selection, ahead of in-vivo studies.
Such a microsystem could be of primary importance for future studies to better understand the EPN effect in a 3D context and to optimize EPN efficiency and associated drug selection, ahead of in-vivo studies.